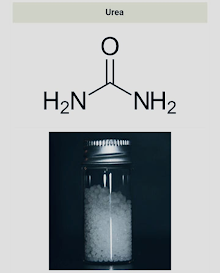
¿Qué son?
Son compuestos orgánicos que se consideran como derivados del amoniaco y resultan de la sustitución de lo hidrógenos de la molécula por los radicales de alquilo.
(Amoniaco: Gas formado por la combinación de un átomo de nitrógenos y tres hidrógeno)
- Se nombra anteponiendo la palabra amina a los nombres de los sustituyentes presentes.
- Cuando los radicales son diferentes se nombran comenzando por el más sencillo de ellos.
- Si los radicales sustituyentes son iguales se emplean los prefijos: mono, di o tri dependiendo el caso.
- El punto de ebullición aumenta con la cantidad de carbonos.
- Las primeras son muy solubles en agua, después van disminuyendo con la cantidad de átomos de carbono.
- Las de bajo peso molecular tiene olores fuertes.
- Las aminas se comportan como bases. Cuando una amina se disuelve en agua, acepta un protón formando un ión alquil-amonio.
- Síntesis de aminas: Las aminas se obtienen tratando derivados halogenados o alcoholes con amoniaco.

- https://prezi.com/hxxyn24-hb5h/amidas-aminas-y-nitrilos/
- http://medicina.usac.edu.gt/quimica/aminas/Propiedades_Qu_micas.htm
- http://linoit.com/users/camilalozano03/canvases/IMPORTANCIA%20%20AMIDAS%20Y%20AMINAS
- http://aminasdaca.blogspot.com/p/usos-de-las-aminas.html?m=1#:~:text=las%20aminas%20son%20empleadas%20para,la%20adrenalina%20y%20la%20noradrenalina
- https://www.google.com/url?sa=i&url=https%3A%2F%2Fquimicaencasa.com%2Fcompuestos-organicos-aminas-ejercicios-resueltos%2F&psig=AOvVaw3W0l58FuxRpjFmpuIGHfQJ&ust=1601675748764000&source=images&cd=vfe&ved=0CAIQjRxqFwoTCLi-9tG1lOwCFQAAAAAdAAAAABAD
- https://www.100ciaquimica.net/images/fororg/ima/an7.gif